引言:CAR-T疗法的“深水区”与临床转化瓶颈
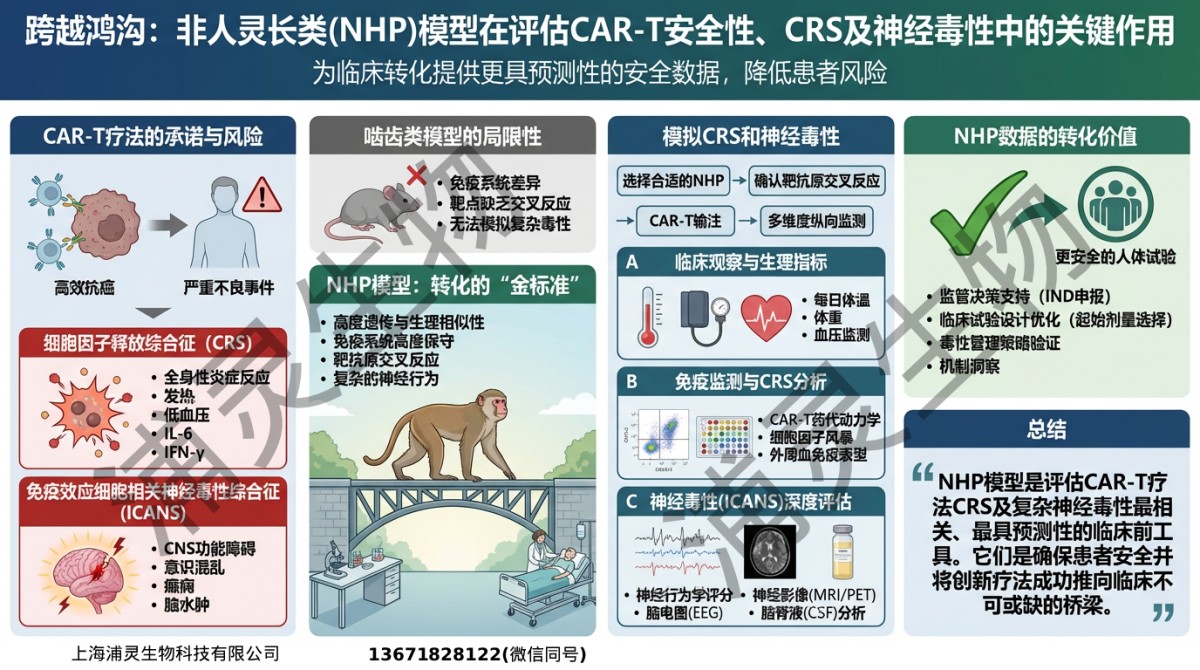
嵌合抗原受体T细胞(CAR-T)疗法已在部分血液恶性肿瘤中取得突破性成果,并逐步拓展至实体瘤治疗。然而,尽管其机制明确、潜力巨大,从实验室研究走向临床应用依旧面临多重挑战。尤其是细胞因子释放综合征(Cytokine Release Syndrome, CRS)与免疫效应细胞相关神经毒性(Immune Effector Cell-Associated Neurotoxicity Syndrome, ICANS),仍是临床和监管机构高度关注的关键安全风险。
传统小鼠模型,尤其是免疫缺陷小鼠,在药效验证中具有不可替代的价值,但由于物种间免疫系统差异显著,它们通常难以准确预测 CRS、神经毒性等复杂的系统性免疫反应。非人灵长类(Non-Human Primates, NHP)因在免疫系统结构、靶抗原序列同源性及组织分布上与人类更为接近,逐渐成为CAR-T疗法开发中重要的补充模型。
为什么CAR-T研发需要重视NHP模型?
对转化研究团队而言,NHP模型的价值不仅在于符合法规要求,更在于其能够提供更贴近临床的安全性与免疫反应信息。
1. 更接近临床的CRS与ICANS风险识别
小鼠模型往往无法再现实临床上“细胞因子风暴”的级联反应,也难以呈现复杂的神经行为学改变。
而NHP模型可实现:
动态监测IL-6、IFN-γ、TNF-α等关键细胞因子水平
结合行为学、神经学指标进行系统化评估
从而在一定程度上模拟临床可能出现的急性系统性毒性反应。
2. 靶点特异性与脱靶效应评估(On-target/Off-tumor)
许多CAR-T靶点本身在正常组织存在低水平表达,因此脱靶毒性风险必须重点评估。
由于人类与NHP之间的蛋白序列同源性通常高于90%,NHP模型能够更为真实地反映潜在的“在靶-脱瘤”毒性风险。
3. 体内PK/PD行为的深入理解
CAR-T的扩增、下降、持久性及体内迁移是影响疗效的核心参数。
在具有完整免疫系统的NHP体内,可以更接近临床条件地观察:
细胞扩增与清除速度
表型变化
向病灶区域的迁移行为
这些信息对临床剂量、给药策略与监测方案制定具有重要参考价值。
NHP模型的重要性与局限性并存
尽管NHP为CAR-T转化提供重要信息,但其并非人类免疫反应的完全复制。
局限性包括:
部分靶点在人/NHP间表达差异依然存在
NHP实体瘤模型构建具有生物学和伦理层面的限制
由于成本与实验规模限制,往往难以进行大样本重复验证
因此,NHP数据应与 体外功能数据 + 小鼠药效模型 + 转化生物标志物 综合整合,以形成更稳健的 “weight-of-evidence” 证据体系。
浦灵生物(Prisys Biotech):以严谨平台支持CAR-T转化研究
作为长期深耕非人灵长类研究的转化医学机构,浦灵生物具备系统的免疫学研究能力、高质量的NHP实验平台,以及成熟的生物样本处理流程。
✔ 已开展的真实经验
浦灵生物已完成 多项CAR-T体外功能研究,包括:
CAR-T细胞杀伤实验(Cytotoxicity assays)
细胞因子释放检测试验
细胞扩增与表型分析
靶点依赖性功能验证
✔ NHP平台可支持的能力
浦灵的NHP平台已用于多类型免疫调节剂、抗体疗法、基因与细胞治疗产品的研究,并具备:
临床类预处理方案(Lymphodepletion-like protocols)的可执行性与安全监测体系
高标准的样本收集、免疫分析、行为学监测流程
PK/PD、免疫表型、细胞因子等多维度分析能力
这些能力为未来CAR-T体内研究提供了完善的基础设施与技术储备。
结语
CAR-T疗法的真正挑战在于如何跨越免疫系统复杂性所带来的不确定性。NHP模型在识别潜在风险、理解免疫动力学方面具有不可替代的价值。浦灵生物将以科学严谨的态度、规范化的平台及丰富的体外免疫研究经验,为CAR-T项目提供稳健、透明且可溯源的转化支持。

Get in Touch
*We respect your confidentiality and all information are protected.
